Kekuatan Asam Dan Basa - Ada beberapa jenis asam dapat diminum atau dikonsumsi, sebaliknya ada beberapa asam yang berbahaya bila kena kulit, karena dapat merusak jaringan. Asam juga dapat merusak logam dan keramik. Apakah asam dan basa mempunyai kekuatan yang sama?
Kekuatan suatu asam atau basa tergantung bagaimana senyawa tersebut dapat diuraikan menjadi ion-ion dalam air. Peristiwa terurainya suatu zat menjadi ion-ionnya dalam air disebut ionisasi.
Asam atau basa yang terionisasi secara sempurna dalam larutan merupakan asam kuat atau basa kuat. Sebaliknya asam atau basa yang hanya terionisasi sebagian merupakan asam lemah atau basa lemah.
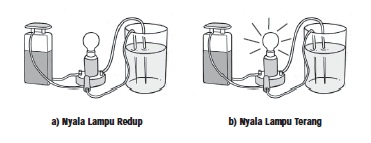
Jika ingin mengetahui kekuatan asam dan basa kamu dapat melakukan percobaan sederhana. Perhatikan nyala lampu saat mengadakan percobaan uji larutan elektrolit. Bila nyala lampu redup berarti larutan tergolong asam atau basa lemah, sebaliknya apabila nyala lampu terang berarti larutan tersebut tergolong asam atau basa kuat.
Derajat Keasaman dan Kebasaan
Derajat Keasaman dan Kebasaan (pH dan pOH) Mungkin Anda pernah mendengar istilah pH suatu larutan. Apakah pH itu? Pada dasarnya derajat/tingkat keasaman suatu larutan (pH = potenz Hydrogen)) bergantung pada konsentrasi ion H+ dalam larutan.Semakin besar konsentrasi ion H+ semakin asam larutan tersebut. Umumnya konsentrasi ion H+ pada larutan sangat kecil, maka untuk menyederhanakan penulisan digunakan konsep pH untuk menyatakan konsentrasi ion H+. Nilai pH sama dengan negatif logaritma konsentrasi ion H+ dan secara matematika dinyatakan dengan persamaan
pH = - log (H+)
Analog dengan pH, konsentrasi ion OH– juga dapat dinyatakan dengan cara yang sama, yaitu pOH (Potenz Hydroxide) dinyatakan dengan persamaan berikut.
pOH = - log (OH-)
Derajat keasaman suatu zat (pH) ditunjukkan dengan skala 0—14.
a. Larutan dengan pH < 7 bersifat asam.
b. Larutan dengan pH = 7 bersifat netral.
c. Larutan dengan pH > 7 bersifat basa.
Jumlah harga pH dan pOH = 14. Misalnya, suatu larutan memiliki pOH = 5, maka harga pH = 14 – 5 = 9. Harga pH untuk beberapa jenis zat yang dapat kita temukan di lingkungan sehari-hari dinyatakan dalam:
No. Harga pH Contoh Material
1.) 1 : Larutan HCl 0,1 M
2.) 6 : Susu
3.) 7 : Air murni
4.) 7,2 : Darah
5.) 14 : Larutan NaOH 1 M
Sekian artikel tentang kekuatan asam dan basa dan juga aertikel tentang derajat keasaman dan kebasaan.
Semoga bermanfaat dan terimakasih telah berkunjung.